Trừu tượng
Tế bào đuôi gai (DC) có thể được phân chia theo dòng dõi thành tế bào đuôi gai dòng tủy (mDC) và tế bào đuôi gai plasmacytoid (pDC). Cả hai đều hiện diện trong các mô niêm mạc và điều chỉnh phản ứng miễn dịch bằng cách tiết ra chemokine và cytokine. Các bệnh viêm ruột (IBDs) được đặc trưng bởi hàng rào ruột bị rò rỉ và hậu quả là sự chuyển vị của lipopolysaccharide vi khuẩn (LPS) sang thành bên. Điều này dẫn đến việc kích hoạt các DC, nhưng phản ứng của các pDC vẫn kém đặc trưng. Trong nghiên cứu này, chúng tôi đã so sánh các phản ứng của mDC và pDC với việc quản lý LPS. Chúng tôi trình bày một loạt các yếu tố được tiết ra từ DC, bao gồm cytokine, chemokine và các yếu tố tăng trưởng. Các nghiên cứu gần đây của chúng tôi đã chứng minh tác dụng chống viêm của việc sử dụng quercetin, nhưng cho đến nay, không có bằng chứng về tác dụng của quercetin đối với bệnh pDCs.Slpi , Hmox1 và AP-1 ).
1. Giới thiệu
Sự chuyển vị thành phần vi sinh vật hoặc vi sinh vật qua niêm mạc ruột có thể dẫn đến hoạt hóa tế bào đuôi gai (DC) và tiết cytokine gây viêm ; phản ứng này cần được hạn chế để tạo điều kiện thuận lợi cho việc sửa chữa mô và trở lại cân bằng nội môi trong ruột; nếu kéo dài, tình trạng viêm mãn tính có thể phát sinh và tiến triển thành các bệnh viêm ruột (IBD). Do đó, DCs cư trú trong các mô bạch huyết liên quan đến ruột (GALT) có liên quan đến việc duy trì khả năng chống chịu đối với hệ vi sinh vật kết hợp có vai trò quan trọng trong sự phát triển của IBDs. Chúng bao gồm viêm loét đại tràng và bệnh Crohn, được đặc trưng bởi rối loạn chức năng hàng rào biểu mô có thể khiến các DC thường trú ở niêm mạc tiếp xúc với lipopolysaccharide (LPS) dồi dào có nguồn gốc từ đèn và hậu quả là kích hoạt quá mức các tế bào miễn dịch bên cạnh việc tiết ra các cytokine gây viêm.
DC có thể được chia thành nhiều tập hợp con theo protein màng và bộ sao mã của chúng. Theo nguồn gốc dòng dõi, có thể phân biệt hai quần thể DCs: DCs dòng tủy (mDCs) và plasmacytoid DCs (pDCs). Các tế bào trước đây có nguồn gốc từ các tế bào sinh dòng tủy hiện diện ở các cơ quan ngoại vi và hoạt động như các tế bào trình diện kháng nguyên, chúng tiết ra các cytokine chống viêm và chống lại các kích thích bên ngoài và điều khiển các tế bào miễn dịch khác về phía tác nhân hoặc phản ứng dung nạp. Mặt khác, pDCs có nguồn gốc từ tiền thân bạch huyết và có liên quan đến việc sản xuất các interferon loại I và III (IFN); chúng chủ yếu tham gia vào quá trình bảo vệ chống lại vi rút nhưng cũng có thể trình bày kháng nguyên để bắt đầu phản ứng miễn dịch thích ứng.
pDC có thể được phân biệt với mDC bằng một số dấu hiệu màng cụ thể. Các pDC Murine biểu hiện ít CD11c hơn nhưng khác với mDC, chúng dương tính với B220 và Ly6C, do đó xuất hiện CD11c int B220 + Ly6C + so với các mDC có CD11c cao B220 – Ly6C. Hơn nữa, pDCs biểu hiện ít phân tử phức hợp tương thích mô chính II (MHCII) ít hơn so với các phân tử dòng tủy của chúng.
pDCs hiện diện ở nhiều khu vực trong cơ thể chúng ta, bao gồm cả đường tiêu hóa, chúng tham gia vào quá trình dung nạp qua đường miệng và phát hiện các kháng nguyên gây bệnh tiềm ẩn (chủ yếu là axit nucleic exogen) đi qua các miếng dán Peyer (PP) và niêm mạc ruột kết. Sau khi được kích hoạt, chúng trình bày kháng nguyên đối với các tế bào tác động trong hạch bạch huyết mạc treo ruột (MLN). pDCs cũng có một vai trò quan trọng trong IBDs. Có bằng chứng về hoạt động của chúng trong cơ chế bệnh sinh của IBDs; những con chuột cạn kiệt pDCs có dấu hiệu viêm nhẹ và giảm các triệu chứng của bệnh viêm đại tràng, cho thấy vai trò hỗ trợ của pDCs trong việc khởi phát quá trình viêm. Ngoài ra, pDCs tiết IFN loại I được cho là tạo ra phản ứng bảo vệ và dung nạp trong các tế bào miễn dịch của cơ quan tác động và do đó làm giảm các triệu chứng IBDs. Vai trò kép này của pDCs trong bệnh viêm ruột phản ánh vai trò quan trọng của chúng như các tế bào điều hòa miễn dịch.
Dựa trên các nghiên cứu trước đây của chúng tôi, chứng minh khả năng của quercetin trong việc ngăn chặn một số con đường của phản ứng viêm mDCs, trong nghiên cứu hiện tại, chúng tôi tập trung chú ý vào tác dụng chống viêm và chống oxy hóa tiềm năng của việc pDCs tiếp xúc với quercetin. Quercetin có trong nhiều loại thực phẩm (hàng tạp hóa và trái cây) thường được gọi là “siêu thực phẩm”. Cùng với một số nhóm khác, chúng tôi đã chứng minh rằng quercetin có thể ngăn chặn phản ứng viêm DCs (BMDC) có nguồn gốc từ tủy xương đối với việc sử dụng LPS, đồng thời, thúc đẩy quá trình sửa chữa mô cả in vivo và in vitro. Đặc biệt, trước khi tiếp xúc với quercetin làm giảm hoạt động trình diện kháng nguyên DC và bài tiết cytokine bằng cách kích hoạt Slpi và chelat hóa sắt ngoại bào, những chất rất quan trọng trong hoạt động và trưởng thành của tế bào miễn dịch. Trước đây chúng tôi cũng đã quan sát thấy sự cải thiện các triệu chứng viêm và rối loạn sinh học ở những con chuột được điều trị bằng chế độ ăn giàu cà chua, được đặc trưng bởi hàm lượng polyphenol cao, bao gồm cả quercetin. Dữ liệu của chúng tôi hỗ trợ một vai trò tiềm năng đối với chế độ dinh dưỡng làm giàu quercetin như một biện pháp phòng ngừa hoặc điều trị các hội chứng viêm đường ruột không mong muốn.
Mặc dù có rất nhiều tài liệu chứng minh tác dụng chống viêm của quercetin và các polyphenol khác trên tế bào miễn dịch, rất ít nghiên cứu về tác dụng của việc sử dụng quercetin đối với bệnh pDCs. Tuy nhiên, quercetin và polyphenol ảnh hưởng đến môi trường vi sinh đường ruột và có thể bảo vệ khỏi rối loạn vi khuẩn và viêm nhiễm, cũng ảnh hưởng đến hoạt động của DCs.
Trong nghiên cứu này, trước tiên chúng tôi đề cập đến sự phong phú của pDC trong GALT của murine, bao gồm PP và MLN, được phân lập từ chuột hoang dã (WT) và mô hình viêm đại tràng tự phát (Winnie). Vì chúng tôi đã quan sát thấy sự hiện diện đáng kể của pDC trong WT và Winnie GALT, chúng tôi đã tìm cách điều tra xem liệu việc tiếp xúc với quercetin có thể ngăn chặn phản ứng viêm của pDC và làm suy giảm sự trưởng thành của chúng hay không, đặc biệt là khi được điều trị bằng LPS.
Do đó, chúng tôi đã phân biệt các pDC và mDC song song (được sử dụng làm đối chứng) từ các tiền chất của tủy xương chuột và so sánh sự bài tiết cytokine của chúng và sự biểu hiện của các gen được chọn trước đây được xác định là trung gian chính trong phản ứng chống viêm do quercetin gây ra. Kết quả của chúng tôi chứng minh rằng các pDC đáp ứng với việc quản lý LPS, tiết ra một loại cytokine gây viêm đặc biệt; Tiếp xúc với quercetin ngăn chặn phản ứng viêm qua trung gian LPS theo cách thức độc lập với Slpi -, Hmox1 – và Ap-1 nhưng không phụ thuộc vào Ptger2- , xác nhận mức độ liên quan tiềm năng của việc sử dụng quercetin như một chiến lược bổ trợ cho bệnh nhân IBD.
2. Kết quả
2.1. Sự hiện diện khác biệt của các tế bào đuôi gai trong PP và MLN của Winnie Mice
Viêm ruột thường xảy ra khi vi khuẩn và các kháng nguyên vi khuẩn như LPS xâm nhập vào lớp chất nhầy lỏng hơn và tiến gần hơn đến các tế bào miễn dịch cư trú trong niêm mạc; do đó, chúng tôi đã kiểm tra sự hiện diện của chúng trong PP và MLN của chuột WT và Winnie. Phân tích FACS cho thấy sự phong phú tương tự của các tế bào CD11c + trong PP cũng như trong MLN của chuột WT và Winnie. Khi được giám sát trên các ô CD11c + , dữ liệu FACS tiết lộ rằng B220 + pDCs và B220 – sự hiện diện của tế bào đuôi gai thông thường (cDCs) là tương tự trong WT và Winnie PP, nhưng chúng tôi đã quan sát thấy sự gia tăng đáng kể CD11c + B220 – CD8 – tế bào đuôi gai có nguồn gốc monocyte (moDC) trong Winnie MLNs so với các đối tác WT của chúng. Cuối cùng, chúng tôi quan sát thấy sự giảm các tế bào CD11c + B220 + , cả hai đều là tế bào đuôi gai ở trạng thái ổn định (CD11c + B220 + CD8 + ) và pDC (CD11c + B220 + CD8 – ) trong MLN của chuột bị viêm.

Biểu đồ mật độ đại diện cho các tế bào đuôi gai (DC) được tìm thấy trong các miếng dán của Peyer (PP) từ chuột loại hoang dã (WT) ( A ) và Winnie ( B ), và trong các bạch huyết mạc treo (MLN) từ WT ( D ) và Winnie ( E ) ; 20.000 tế bào đã được thu nhận cho mỗi điều kiện. Biểu đồ thể hiện tỷ lệ phần trăm của các quần thể DC khác nhau ở PP ( C ) và MLN ( F ) ở chuột WT và Winnie; các thanh đại diện cho biểu thức tương đối trung bình ± SEM ( n = 4) cho mỗi kiểu gen. * p <0,05 **** p <0,0001.
2.2. Tạo ra Murine pDC từ tiền thân tuỷ xương
Như ở chuột Winnie, lớp chất nhầy thường xuyên không bền hơn ở chuột WT, pDC có khả năng tiếp xúc với các kháng nguyên bên ngoài với LPS là một trong số chúng. Tiếp theo, chúng tôi điều tra xem liệu các pDC được nuôi cấy trong ống nghiệm có thể biểu hiện thụ thể giống số 4 ( Tlr4 ) và có thể đáp ứng với LPS hay không.
Chúng tôi đã tạo pDC và mDC trong ống nghiệm từ các tiền chất chung của tủy xương chuột, với phối tử tyrosine kinase 3 giống FMS(Flt3L) và yếu tố kích thích thuộc địa bạch cầu hạt-đại thực bào (GM-CSF) + interleukin 4 (IL-4), tương ứng. Sử dụng phương pháp phân tích so sánh tế bào, chúng tôi đã xác nhận sự trưởng thành hiệu quả của tế bào sinh trưởng tủy xương thành tế bào CD11c + B220 + Ly6C + được nuôi cấy bằng Flt3L trong môi trường nuôi cấy. Hình 2A-E mô tả sự biểu hiện các dấu hiệu bề mặt khác nhau trong tế bào nuôi với GM-CSF + IL-4 (CD11c + B220 – Ly6C – tế bào) so với những người Flt3L (CD11c + B220 + Ly6C + tế bào). Đáng chú ý, các tế bào được nuôi cấy bằng Flt3L có khoảng 20% CD11c + B220 neg , 45% CD11c + B220 int , và 25% CD11c + B220 tế bào cao . Điều thú vị là 24 giờ sau khi kích thích LPS, các tế bào được nuôi cấy Flt3L là 5% CD11c + B220 neg , 35% CD11c + B220 int và 45% CD11c +Cao B220 . Những dữ liệu này chỉ ra rằng ngay cả trong sự hiện diện của nuôi cấy tế bào không đồng nhất, các tế bào đã phản ứng với sự biểu hiện bề mặt B220 điều hòa LPS.

Biểu đồ mật độ đại diện cho nhuộm CD11c, B220 và Ly6C trong mDCs ( A ), tế bào đuôi gai dòng tủy (mDC) được kích thích bằng lipopolysaccharide (LPS) trong 24 giờ ( B ), tế bào đuôi gai plasmacytoid (pDC) ( C ), pDC được kích thích bằng LPS trong 24 giờ ( D ). Biểu đồ thanh cho trung bình ± SEM ( n = 4) hiển thị tỷ lệ phần trăm của tế bào CD11c + B220 + Ly6C + ( E ), tế bào CD11c + CD80 + ( F ) và phức hợp tương thích mô chính II (MHCII) MFI (cường độ huỳnh quang trung bình) ( NS) trong kiểm soát và sau khi kích thích LPS trong 24 giờ. Biểu đồ thanh thể hiện giá trị trung bình ± SEM ( n = 6) của biểu hiện gen giống thụ thể số 4 ( Tlr4 ) so với mDCs đối chứng ( H ). * p <0,05 *** p <0,001 **** p <0,0001.
pDC có thể đáp ứng với LPS bằng cách điều chỉnh sự biểu hiện của MHCII, nhưng không phải CD80 (Hình 2F – G). Phù hợp với các kết quả nói trên, chúng tôi phát hiện TLR4 biểu tại PDC (Hình 2H) ngay cả khi thấp hơn đáng kể so với những gì quan sát được trong mDC.
2.3. Quercetin ngăn chặn sự tiết Cytokine và Chemokine ở cả mDC và pDC
Dựa trên những quan sát này, tiếp theo, chúng tôi điều tra xem liệu trước khi tiếp xúc với quercetin có thể ngăn chặn khả năng giải phóng cytokine và chemokine gây viêm của pDCs tương tự như những gì đã được quan sát trước đó ở mDC. Trong các nghiên cứu trước đây của chúng tôi, 25 µM quercetin có thể ngăn chặn sự bài tiết các cytokine gây viêm ở các mDC được kích thích bằng LPS mà không gây chết tế bào. Do đó, chúng tôi đã sử dụng các điều kiện giống hệt nhau để kiểm tra tác dụng của quercetin đối với pDC.
Theo quan sát của chúng tôi, quercetin làm giảm đáng kể sự điều chỉnh MHCII và CD80 ở các pDC được kích thích bằng LPS (Hình 3A, B). Hơn nữa, quercetin không ảnh hưởng đến khả năng tồn tại của tế bào vì các tế bào dương tính với 7-Aminoactinomycin D (7-AAD) là khoảng 30% trong tất cả các điều kiện thử nghiệm (Hình 3NS).

Biểu đồ thanh thể hiện giá trị trung bình ± SEM ( n = 4) đối với biểu hiện MHCII MFI và CD80 ( A , B ) và nhuộm 7-Aminoactinomycin D (7-AAD) sức sống ( C ) của mDC và pDC trong điều kiện ban đầu và sau khi kích thích bằng LPS và / hoặc quercetin. *** p <0,001 **** p <0,0001.
Chúng tôi đã thử nghiệm việc giải phóng 36 cytokine, chemokine và các yếu tố tăng trưởng bằng pDCs tiếp xúc trước quercetin 24 giờ sau khi được kích hoạt với LPS. Các pDC và mDC được xử lý bằng phương tiện được sử dụng để kiểm soát. Một bảng tổng hợp về các tác động của quản lý LPS đối với mDC và pDC được trình bày trong Hình 4, Hình 5 và Hình 6. Phù hợp với những gì đã được mô tả trước đây, việc sử dụng quercetin có thể ngăn chặn sự bài tiết của hầu hết các chất trung gian gây viêm được hiển thị trong bảng. Đáng lưu ý, mặc dù giảm biểu hiện của Tlr4 , pDCs đáp ứng với kích thích LPS bằng cách tiết ra lượng IL-10, IL-12p70, IL-27 và yếu tố hoại tử khối u (TNF) cao hơn nếu so với mDCs (hinh 4). Chúng cũng tiết ra một lượng tương tự IL-6 và một lượng lớn chemokine như chemokine (CC motif) phối tử 3 (CCL3), CCL4, CCL5, CXC Motif Chemokine Ligand 1 (CXCL1), CXCL2 và CXCL5 (Hình 5). Thậm chí đáng kể hơn so với mDC, pDC điều chỉnh giảm sự bài tiết của từng yếu tố được phân tích khi tiếp xúc với quercetin 24 giờ trước khi kích thích bằng LPS. Hơn nữa, mặc dù pDCs là tế bào tiết IFNα chính, cytokine này không được phát hiện trong môi trường nuôi cấy pDCs sau khi kích thích bằng LPS (hinh 4).

Biểu đồ phân tán biểu thị giá trị trung bình ± SEM ( n = 5) cho các cytokine tiết ra của mDC và pDC trong điều kiện ban đầu và sau khi kích thích bằng LPS và / hoặc quercetin. * p <0,05 ** p <0,005 *** p <0,001 **** p <0,0001; $ p <0,05 $$ p <0,005 $$$ p <0,001 $$$$ p <0,0001; * LPS so với quercetin + LPS; $ mDCs so với pDCs.

Biểu đồ phân tán biểu thị giá trị trung bình ± SEM ( n = 5) cho các chemokine được tiết ra của mDC và pDC trong điều kiện cơ bản và sau khi kích thích bằng LPS và / hoặc quercetin. * p <0,05 *** p <0,001 **** p <0,0001; $$$ p <0,001 $$$$ p <0,0001; * LPS so với quercetin + LPS; $ mDCs so với pDCs.

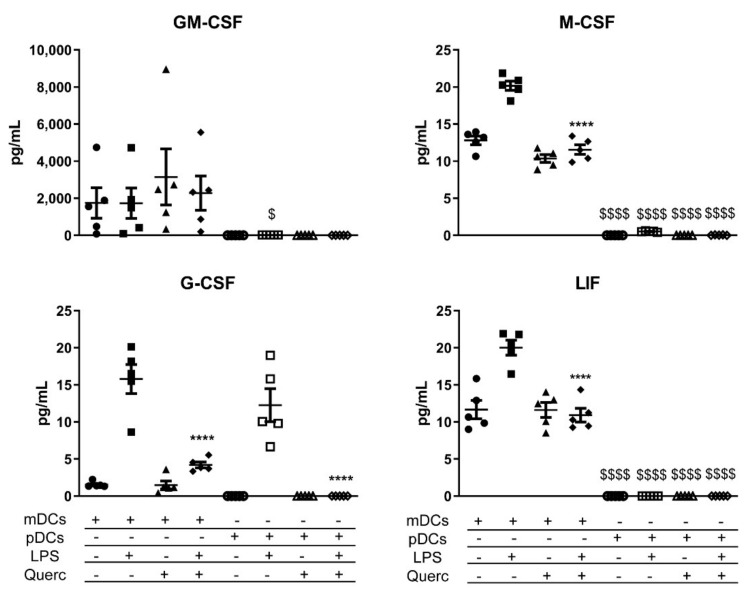
Biểu đồ phân tán biểu thị giá trị trung bình ± SEM ( n = 5) cho các yếu tố tăng trưởng được tiết ra của mDC và pDC trong điều kiện cơ bản và sau khi kích thích bằng LPS và / hoặc quercetin. **** p <0,0001; $ p <0,05 $$$$ p <0,0001; * LPS so với quercetin + LPS; $ mDCs so với pDCs.
Nhìn vào sự bài tiết của các yếu tố tăng trưởng, mDC là những nhà sản xuất chính của GM-CSF, yếu tố kích thích thuộc địa bạch cầu hạt (G-CSF), yếu tố kích thích thuộc địa đại thực bào (M-CSF), và yếu tố ức chế bệnh bạch cầu (LIF); thay vào đó, pDC chỉ tiết ra một lượng nhỏ G-CSF, tương tự như mDC sau khi quản lý LPS (Hình 6).
2.4. Quercetin điều chỉnh các dấu hiệu phân tử gây viêm trong pDCs
Các kết quả trước đây chứng minh rằng pDC phản ứng với LPS tương tự như mDC. Phân tích sự biểu hiện mRNA của cả hai loại tế bào, chúng tôi xác nhận sự biểu hiện của Tlr4 bởi mDC và, mặc dù thấp hơn, từ pDC (Hình 2, Hình 7).

Các con đường phân tử được kích hoạt trong mDCs và pDCs 6 giờ sau khi kích thích LPS và / hoặc sử dụng quercetin. Biểu đồ thanh thể hiện giá trị trung bình ± SEM ( n = 6) của mỗi biểu hiện gen liên quan đến mDCs đối chứng. * p <0,05 ** p <0,005 **** p <0,0001; $$ p <0,005 $$$ p <0,001 $$$$ p <0,0001; * LPS so với quercetin + LPS; $ mDCs so với pDCs.
Gần đây chúng tôi cũng đã chứng minh rằng quercetin ảnh hưởng đến các con đường truyền tín hiệu nội bào dẫn đến việc bài tiết các cytokine gây viêm, bằng cách điều chỉnh quá trình phiên mã của chất ức chế leucoprotease tiết ( Slpi ) và heme-oxygenase 1 ( Hmox1 ), gen sau liên quan đến việc giảm ứng suất oxy hóa.
Sử dụng RT-qPCR, chúng tôi đã phân tích các đường biểu hiện trong điều kiện thử nghiệm của chúng tôi. Đúng như dự đoán, các biểu hiện Slpi và Hmox1 được gây ra bởi quercetin trong mDC, trong khi biểu hiện của chúng bị giảm xuống ở các tế bào chỉ được kích thích bằng LPS. Đồng thời, pDCs cho thấy điều chế phiên mã Slpi và Hmox1 tương tự được gây ra bởi quercetin và LPS (Hình 7).
Chúng tôi đã kiểm tra thêm sự biểu hiện của yếu tố điều hòa interferon 7 ( Irf7 ) và gen Irf8 , cả hai đều liên quan đến việc kích hoạt các protein tác động hạ lưu của phản ứng viêm và điều hòa bài tiết các cytokine gây viêm. Như mong đợi, cả hai gen đều được biểu hiện trong pDC, ở mức độ thấp hơn so với mDC, nhưng chúng được điều chế bởi quercetin, ngay cả khi có LPS.
Các gen điều chỉnh và điều chỉnh phản ứng viêm và giảm stress oxy hóa, chẳng hạn như indoleamine 2,3-dioxygenase 2 ( Ido2 ) và yếu tố hạt nhân erythroid 2 liên quan đến yếu tố 2 ( Nrf2 ), cho thấy biểu hiện gia tăng ở cả mDC và pDC được kích thích bằng LPS ; tuy nhiên, mức Ido2 thấp hơn đáng kể trong các pDC. Việc sử dụng quercetin có thể làm giảm tình trạng viêm tế bào, được chứng minh bằng việc giảm đáng kể mức độ biểu hiện của cả hai gen này. Con đường phân tử gây ra bởi việc sử dụng quercetin độc lập với sự điều hòa của thụ thể prostaglandin E 2 ( Ptger2 ) khác với những gì đã báo cáo trước đây ở đại thực bào, nhưng nó liên quan đến sự gia tăng rõ rệt sự biểu hiện của mRNA của protein hoạt hóa 1 ( Ap-1 ), yếu tố phiên mã điều chỉnh sự biểu hiện gen để đáp ứng với LPS, ở cả hai loại tế bào tiếp xúc với quercetin; chỉ trong mDCs, biểu hiện của nó được điều chỉnh đáng kể khi quercetin được sử dụng để chống lại sự kích thích bằng LPS.
3. Thảo luận
Trong vài năm qua, chúng tôi đã quan sát thấy một số tác dụng chống viêm do sử dụng quercetin cả in vitro sử dụng mDCs và in vivo bằng cách sử dụng các mô hình viêm loét đại tràng cấp tính và nhẹ. Cùng với một tài liệu rộng lớn, kết quả của chúng tôi cho thấy rằng quercetin có thể hoạt động trên nhiều loại tế bào với các cơ chế phân tử đa dạng. Vì pDCs quan trọng nhưng vẫn còn kém đặc trưng của phản ứng miễn dịch niêm mạc, chúng tôi muốn hiểu liệu tiếp xúc với quercetin có thể ngăn chặn con đường viêm nhiễm và sự trưởng thành của pDCs hay không.
pDC có vai trò quan trọng trong phản ứng miễn dịch; chúng điều phối các phản ứng viêm hướng đến nhiễm vi-rút cũng như chống lại vi khuẩn. Chúng thường được kích hoạt bởi các axit nucleic ngoại sinh thông qua TLR7 và TLR9, nhưng phản ứng với LPS vẫn còn đang được tranh luận. Mặc dù vậy, trong bản thảo hiện nay, chúng tôi chứng minh rằng pDCs có nguồn gốc từ tế bào sinh dục tủy xương của chuột được nuôi cấy trong ống nghiệm với Flt3L có thể được kích hoạt và đáp ứng hiệu quả với kích thích LPS bằng cách điều chỉnh sự biểu hiện của các dấu hiệu bề mặt và bằng cách tiết ra nhiều loại cytokine gây viêm.
Nghiên cứu của chúng tôi trước hết chứng minh rằng pDCs đại diện cho một phần đáng kể của quần thể CD11c + trong PP và MLN của chó trong các điều kiện sinh lý và bệnh lý. So với kiểm soát WT, chúng tôi quan sát thấy sự gia tăng của moDCs và giảm DC ở trạng thái ổn định có thể phản ánh tình trạng viêm của MLN trong thời gian hoạt động, nhưng nhẹ, viêm đại tràng.
Vì pDC có nhiều trong GALT của chuột WT và Winnie, chúng tôi đã điều tra xem liệu việc phơi nhiễm trước với quercetin có thể ảnh hưởng đến phản ứng viêm của pDC được nuôi cấy trong ống nghiệm tương tự như những gì chúng tôi quan sát được với mDC.
Flt3L là một yếu tố tăng trưởng được sử dụng trong việc lựa chọn và biệt hóa các tiền thân của tủy xương; nó hướng chúng đến kiểu hình DC, và nó rất quan trọng trong việc tạo ra pDC. Sử dụng Flt3L, chúng tôi đã tạo thành công pDC sau 10 ngày nuôi cấy và xác nhận sự biểu hiện của các protein bề mặt B220 và Ly6C trong hơn 75% tế bào CD11c + .
pDCs đáp ứng với axit nucleic xuất tiết, nhưng trong quá trình viêm đường ruột, hàng rào biểu mô trở nên dễ dàng hơn đối với sự chuyển vị của sản phẩm vi khuẩn, bao gồm cả LPS, điều này có thể làm trầm trọng thêm các phản ứng viêm. Trong nghiên cứu này, LPS được sử dụng như một chất kích thích gây viêm cho pDCs. Đáp ứng với LPS thường yêu cầu biểu thức Tlr4. Tài liệu không rõ ràng và thường không thống nhất về biểu hiện của Tlr4bởi pDCs; tuy nhiên, trong thiết lập thử nghiệm của chúng tôi, các tế bào được nuôi cấy Flt3L tạo ra một quần thể không đồng nhất được làm giàu pDCs có thể đáp ứng với LPS và tiết ra các cytokine gây viêm. Tính không đồng nhất của tế bào được nhấn mạnh thêm bởi nồng độ IL-17A thấp nhưng vẫn có thể phát hiện được trong phần nổi của mDC và pDC sau khi kích thích LPS. Các nghiên cứu trong tương lai sẽ yêu cầu phân loại tế bào để cải thiện độ tinh khiết của tế bào và ngăn ngừa những ô nhiễm này. Tế bào nuôi cấy Flt3L biểu hiện mRNA Tlr4 thấp hơn nhưng vẫn có thể phát hiện được . Trong các điều kiện thử nghiệm này, chúng tôi không thể loại trừ rằng Tlr4 được phát hiện được biểu thị bằng 20% CD11c + B220 negtế bào được quan sát; Tuy nhiên, sự điều tiết B220 trên bề mặt và sự bài tiết cytokine cho thấy rõ ràng rằng các pDC đáp ứng hiệu quả với việc sử dụng LPS. Hơn nữa, biểu thức MHCII được điều chế đáng kể khi các pDC tiếp xúc với LPS.
Quercetin và polyphenol đã chứng minh nhiều lần tiềm năng chống viêm và điều hòa miễn dịch của chúng; tuy nhiên, người ta biết rất ít về ảnh hưởng của chúng đối với pDC. Ở đây, chúng tôi đã chứng minh rằng quercetin ảnh hưởng đến trạng thái viêm của pDC tương tự như mDC mà không ảnh hưởng đáng kể đến sức sống của tế bào. Việc sử dụng quercetin làm giảm hiệu quả sự bài tiết các cytokine gây viêm từ các pDC trưởng thành cũng như mDC. Nó cũng ngăn chặn rõ rệt sự biểu hiện quá mức của MHCII và CD80 sau khi sử dụng LPS. Những quan sát này ngụ ý rằng quercetin cũng có thể ngăn chặn sự kích hoạt và trưởng thành của các pDC.
Cùng với những quan sát trước đây của chúng tôi về mDC, bảng gồm 36 cytokine và chemokine đã cung cấp những hiểu biết hữu ích về tác dụng ức chế của quercetin đối với hoạt động gây viêm trên các DC có nguồn gốc từ các dòng khác nhau. LPS kích hoạt sự bài tiết của nhiều cytokine trong cả hai loại tế bào, với một số cytokine được biểu hiện khác biệt, và quercetin có thể ngăn chặn sự biểu hiện của chúng trong mDC cũng như trong pDC. Nhìn vào các pDC được kích hoạt bằng LPS, nghiên cứu của chúng tôi cho thấy khả năng tiết ra cytokine của họ IL-12 cao hơn đáng ngạc nhiên, thậm chí cao hơn mDCs, để tiết ra các cytokine thuộc họ IL-12, cụ thể là IL-12p70, IL-10 và IL-27 sau khi quản lý LPS. Trước khi tiếp xúc với quercetin ức chế hoàn toàn sự bài tiết cytokine ở bệnh nhân pDC với hiệu quả vượt trội hơn so với những gì được quan sát thấy ở bệnh nhân mDC. Tương tự, việc tiết IL6, IL-18 và TNF là tương tự ở các pDC và mDC được kích thích bằng LPS, nhưng trước khi tiếp xúc với quercetin hiệu quả hơn đáng kể trong việc ức chế bài tiết cytokine của pDC so với mDC. Một số cytokine được chọn có trong các chất nổi của mDCs không được tiết ra bởi pDCs; chúng bao gồm IL-3, IL-4, IL-9, IL-13, IL-28, IL-31, IFNα và IFNβ. Với những kết quả này, chúng ta có thể giả định rằng pDC và mDC thực hiện hoạt động điều hòa miễn dịch không dư thừa sau khi kích thích LPS, tự động điều chỉnh phản ứng của chúng đối với mầm bệnh, nhưng các pDC dễ bị phơi nhiễm trước quercetin hơn. Như đã đề cập trước đây, nuôi cấy Flt3L tạo ra một quần thể tế bào không đồng nhất; do đó, chúng tôi tự hỏi liệu nồng độ cao của các cytokine đã chọn được phát hiện trong các tế bào được xử lý LPS được nuôi cấy bằng Flt3L có thể là kết quả của sự kích thích hiệp đồng giữa cDC và pDC hay không. Để giải quyết câu hỏi này, chúng tôi đã cấy ghép mDC và pDC theo tỷ lệ 1: 1 và thu thập phần nổi của chúng trong 24 giờ sau khi kích thích LPS. Các kết quả thể hiện trong Hình S1 chỉ ra rằng không có tác dụng hiệp đồng gây ra khi nuôi cấy cả hai loại tế bào vì nồng độ cytokine không tăng lên so với mDC và pDC được nuôi cấy đơn lẻ.
Trước sự ngạc nhiên của chúng tôi, các pDC được kích thích bằng LPS không tiết ra IFNα. Đó thực sự là điều mà Okada đã quan sát được là các phối tử LPS và TLR4 không kích hoạt sự tiết IFNα của các DC. Hình S2 cho thấy pDC biểu hiện Ifnα2 khi được kích hoạt bởi chất chủ vận TLR9 thông qua con đường IRF7.
Trước khi tiếp xúc với Quercetin hoàn toàn ngăn cản chemokine được giải phóng bởi các pDC sau khi kích thích LPS, ngoại trừ CXCL2 có thể phát hiện được, ngay cả khi giảm đáng kể. Một lần nữa, hiệu ứng trước phơi nhiễm của quercetin trong pDCs mạnh hơn mDC.
Việc phân tích các yếu tố tăng trưởng ở cả hai loại tế bào cho thấy sự khác biệt rõ rệt trong việc tiết G-CSF, M-CSF, GM-CSF và LIF. Theo hiểu biết của chúng tôi, những yếu tố này gây ra sự khác biệt và tuyển dụng bạch cầu trung tính, đại thực bào và các DC khác; thú vị là, có bằng chứng về sự thiên lệch đối với sự khác biệt của cDCs với chi phí của pDCs khi các yếu tố này được tiết ra tại vị trí viêm. Dữ liệu của chúng tôi chứng minh thêm rằng mDC nhận ra mối đe dọa lây nhiễm vi khuẩn khi được kích thích bằng LPS và do đó thúc đẩy phản ứng miễn dịch hướng tới việc tuyển dụng các tế bào có khả năng chống lại mầm bệnh vi khuẩn một cách hiệu quả, trong khi pDC được trang bị tốt hơn để đối mặt với vi rút. Đặc biệt, việc tạo ra LIF có liên quan đến việc ngăn chặn sự khác biệt đối với các pDC, có thể giải thích tỷ lệ giảm không đáng kể của các pDC được quan sát thấy trong Winnie MLNs. Nhìn chung, bằng chứng này ủng hộ kết quả thu được ở chuột Winnie.
Sau đó, chúng tôi so sánh con đường chất ức chế phân tử được kích hoạt bởi quercetin. Chúng ta biết rằng gen Slpi đóng vai trò quan trọng trong việc kiểm soát con đường phân tử này, vì các DC Slpi-KO không phản ứng với việc tiếp xúc với quercetin. Như chúng tôi mong đợi, biểu hiện Slpi được điều chế bởi một mình quercetin và khi nó được sử dụng để ngăn chặn tác động của LPS trong cả mDC và pDC. mDCs và pDCs biểu hiện Irf7 và Irf8 , là những gen quy định sự biểu hiện của các cytokine tiền viêm; Sự kích thích LPS gây ra sự điều chế của cả hai gen này. Tuy nhiên, các pDC thể hiện ít hơn đáng kể Irf8, liên quan chủ yếu đến việc sản xuất IFN loại I sau khi nhiễm virus. Như được xác nhận bởi biểu hiện cytokine của IFNα, chúng ta có thể suy ra rằng kích thích LPS không kích hoạt phản ứng kháng vi-rút bền vững trong mDC và pDC.
Việc sử dụng quercetin gây ra sự biểu hiện của Hmox1 và Ap-1, là hai gen liên quan đến việc giảm stress oxy hóa và bài tiết các cytokine gây viêm. Vì quercetin làm tăng hoạt động của Slpi và ngăn chặn yếu tố hạt nhân kappa-chất tăng cường chuỗi ánh sáng của tế bào B hoạt hóa (NFkB), chúng tôi có thể đề xuất và hỗ trợ giả thuyết của mình, vì NFkB và Ap-1 hoạt động thay thế trong việc kích hoạt các gen cytokine gây viêm. . Hơn nữa, nếu Ap-1 được biểu hiện khi NFkB bị ức chế, các tế bào sẽ trải qua một quá trình bất hoạt dần dần và có thể bắt đầu quá trình apoptosis. Mặc dù quercetin ngăn chặn căng thẳng oxy hóa và phản ứng viêm tế bào, biểu hiện Nrf2 thấp hơn ở các tế bào tiếp xúc với polyphenol này. Nhiều nghiên cứu ủng hộ luận điểm rằng Nrf2 được biểu hiện quá mức trong quá trình căng thẳng oxy hóa và viêm và được điều hòa bởi quercetin, mặc dù điều này diễn ra trong giai đoạn đầu sau khi sử dụng quercetin. Trong nghiên cứu này, chúng tôi đã quan sát thấy tác động cuối cùng của việc kích hoạt nó, với việc giảm trạng thái viêm tế bào và sự biểu hiện của gen Hmox1 liên quan đến Nrf2 . Cuối cùng, Ido2sự điều biến ở cả mDC và pDC phù hợp với vai trò của nó như một chất điều hòa phản ứng viêm; gen này thực sự hoạt động như một bộ điều khiển bài tiết cytokine và “cấm” các tế bào miễn dịch tiết ra quá nhiều cytokine, do đó thúc đẩy các phản ứng viêm không kiểm soát được.
4. Vật liệu và Phương pháp
4.1. Nghiên cứu động vật
Các cuộc điều tra của chúng tôi được thực hiện theo quy trình động vật có liên quan, đã được Ủy ban chăm sóc động vật thể chế của Viện tiêu hóa quốc gia “S. de Bellis ”(Sinh vật tham gia tuân thủ Sức khỏe Động vật: OPBA). Tất cả các thí nghiệm trên động vật đều được thực hiện theo hướng dẫn quốc gia của Ý chỉ thị n. 26/2014 và được sự chấp thuận của Ủy ban Đạo đức Động vật của Bộ Y tế Ý – Tổng cục Thú y và Thuốc Thú y (DGSAF- Prot. 768/2015-PR 27/07/2015). Tất cả các động vật được duy trì trong một môi trường được kiểm soát (20–22 ° C, chu kỳ 12 giờ sáng và 12 giờ tối, và độ ẩm tương đối 45–55%).
4.2. Phân lập tế bào đơn từ các hạch bạch huyết mạc treo Murine và các bản vá của Peyer
Chuột WT và Winnie đã bị hy sinh, MLN và PP của chúng được tách ra, làm sạch chất béo, và đưa vào môi trường RPMI 1640 (Thermo Fisher Scientific, Waltham, MA, USA). Để có được huyền phù đơn bào, MLN được đập vỡ bằng DPBS 1X (Thermo Fisher Scientific, Waltham, MA, USA) + 0,5 mM EDTA (Thermo Fisher Scientific, Waltham, MA, USA) và đi qua bộ lọc tế bào 40 µm (Miltenyi Biotec , Bergisch Gladbach, Đức). Huyền phù đơn bào từ PP thu được sau khi phân hủy bằng collagenase loại IV và DNase I (Sigma Aldrich, St. Louis, MO, Hoa Kỳ) trong 30 phút ở 37 ° C trên bệ rung. Hỗn dịch đơn bào thu được được tạo viên bằng cách ly tâm, rửa bằng DPBS 1X + 0,5 mM EDTA, và đi qua bộ lọc tế bào 100 μm, 70 μm và 30 μm (Miltenyi Biotec, Bergisch Gladbach, Đức). Sau đó,
4.3. Tạo mDCs và pDCs từ tủy xương Murine
Tế bào đuôi gai từ tủy xương của chuột được tạo ra từ những con chuột WT sáu đến tám tuần tuổi; họ đã hy sinh, xương chày và xương đùi của họ được rửa sạch bằng 0,5 mM EDTA (Thermo Fisher Scientific, Waltham, MA, USA). Sau đó, các tế bào hồng cầu được ly giải bằng chất đệm ACK (Thermo Fisher Scientific, Waltham, MA, USA). Huyền phù đơn bào thu được được phân tách để tạo mDCs và pDCs. Để tạo mDCs, các tế bào được mạ trong đĩa 10 mL ở nồng độ 1 × 10 6tế bào / mL trong môi trường RPMI 1640 (Thermo Fisher Scientific, Waltham, MA, USA) bổ sung 10% huyết thanh bò thai bất hoạt nhiệt (FBS, Thermo Fisher Scientific, Waltham, MA, USA), 100 U / mL penicilin / streptomycin ( Thermo Fisher Scientific, Waltham, MA, USA), 1% HEPES 1M (Thermo Fisher Scientific, Waltham, MA, USA), 1% aminoacid không thiết yếu 100 mM (Thermo Fisher Scientific, Waltham, MA, USA), 1% L -glutamine (Thermo Fisher Scientific, Waltham, MA, USA), 1% sodium pyruvate 100 mM (Thermo Fisher Scientific, Waltham, MA, USA), 25 ng / mL mGM-CSF (Miltenyi Biotec, Bergisch Gladbach, Germany), 25 ng / mL mIL-4 (Miltenyi Biotec, Bergisch Gladbach, Đức) như đã làm trước đây, và được nuôi cấy ở 37 ° C trong môi trường 5% CO 2 được làm ẩm .
Để tạo pDCs, các tế bào được mạ trong đĩa nuôi cấy 6 giếng ở nồng độ 2 × 10 6 tế bào / mL trong môi trường RPMI 1640 (Thermo Fisher Scientific, Waltham, MA, USA) được bổ sung 10% FBS bất hoạt nhiệt (Thermo Fisher Scientific, Waltham, MA, USA), 100 U / mL penicillin / streptomycin (Thermo Fisher Scientific, Waltham, MA, USA), 1% HEPES 1M (Thermo Fisher Scientific, Waltham, MA, USA), 1% không thiết yếu aminoacids 100 mM (Thermo Fisher Scientific, Waltham, MA, USA), 1% L-glutamine (Thermo Fisher Scientific, Waltham, MA, USA), 1% sodium pyruvate 100 mM (Thermo Fisher Scientific, Waltham, MA, USA), 200 ng / mL mFlt3L (Miltenyi Biotec, Bergisch Gladbach, Đức), và được nuôi cấy ở 37 ° C trong môi trường 5% CO 2 được làm ẩm .
Vào ngày thứ 10 sau khi phân lập, tất cả các tế bào không kết dính được nhẹ nhàng thu hoạch và mạ trên đĩa nuôi cấy 6 giếng ở nồng độ 2,5 × 10 6 tế bào / mL để phân tích phương pháp đo lượng tế bào. Sau đó, 25 µM quercetin (Sigma-Aldrich, St Louis, MO, Hoa Kỳ) được sử dụng cho cả pDC và mDC; 24 giờ sau, các tế bào được kích thích với 1 µg / mL Salmonella Typhimurium LPS (Sigma-Aldrich, St. Louis, MO, USA) hoặc 3 µg / mL CpG ODN 2216 hoặc 3 µg / mL CpG ODN 2243 Control (Miltenyi Biotec, Bergisch Gladbach, Đức). Sau đó, 24 giờ sau đó, tế bào được thu hoạch, trong khi chất nổi phía trên được thu thập và lưu trữ để phân tích thêm.
Đối với các thí nghiệm nuôi cấy, mDCs và pDCs được thu hoạch từ các đĩa nuôi cấy tương ứng của chúng vào ngày thứ 10 sau khi phân lập và được mạ theo tỷ lệ 1: 1 trong môi trường RPMI 1640 (Thermo Fisher Scientific, Waltham, MA, USA) được bổ sung 10% nhiệt bất hoạt FBS (Thermo Fisher Scientific, Waltham, MA, USA), 100 U / mL penicillin / streptomycin (Thermo Fisher Scientific, Waltham, MA, USA), 1% HEPES 1M (Thermo Fisher Scientific, Waltham, MA, USA), 1% các aminoacid không thiết yếu 100 mM (Thermo Fisher Scientific, Waltham, MA, USA), 1% L-glutamine (Thermo Fisher Scientific, Waltham, MA, USA), 1% sodium pyruvate 100 mM (Thermo Fisher Scientific, Waltham, MA, HOA KỲ). Sau đó, 24 giờ sau, các tế bào được kích thích với 1 µg / mL Salmonella Typhimurium LPS (Sigma-Aldrich, St. Louis, MO, USA). Sau đó, 24 giờ sau đó, các tế bào được thu hoạch,
4.4. Phân tích đo lưu lượng tế bào
mDC và pDC được tách ra khỏi đĩa bằng DPBS 1X (Thermo Fisher Scientific, Waltham, MA, USA) + 0,5 mM EDTA (Thermo Fisher Scientific, Waltham, MA, USA). Sau đó, các tế bào được rửa bằng DPBS 1X + 0,5% BSA (Sigma-Aldrich, St. Louis, MO, USA) và được dán nhãn CD8a FITC, Ly6C FITC, CD11c APC-Vio770, CD45R (B220) PE-Vio770, CD11c PE, Dung dịch nhuộm MHCII APC, CD80 FITC và 7-AAD (Miltenyi Biotec, Bergisch Gladbach, Đức). Việc thu thập lưu lượng kế được thực hiện bằng NAVIOS (Beckman Coulter, Brea, CA, USA). Phân tích lưu lượng tế bào được thực hiện bằng Phần mềm Kaluza 1.5 (Beckman Coulter, Brea, CA, Hoa Kỳ).
4.5. Phân tích bài tiết Cytokine
Xét nghiệm đa cytokine được thực hiện bằng cách sử dụng Cytokine & Chemokine Convenience 36-Plex Mouse ProcartaPlex ™ Panel 1A (Thermo Fisher Scientific, Waltham, MA, USA) trên bề mặt nuôi cấy tế bào từ 3 thí nghiệm độc lập.
Sự bài tiết cytokine của các chất nổi nuôi cấy cũng được phân tích bằng cách sử dụng bộ dụng cụ ELISA cho IL-6, IL-12p70 và TNF (R&D Systems, Minneapolis, MN, USA) theo hướng dẫn của nhà sản xuất.
4.6. Tách chiết RNA và phân tích qPCR
mDCs và pDCs sau 10 ngày nuôi cấy được kích thích bằng LPS trong 6 giờ và sau đó được thu hoạch trong TRIzol ® (Thermo Fisher Scientific, Waltham, MA, USA); RNA tổng số được phân lập từ các tế bào đó theo hướng dẫn của nhà sản xuất. Một µg được phiên mã ngược bằng cách sử dụng bộ tổng hợp cDNA iScript (Biorad, Hercules, CA, USA) với các đoạn mồi ngẫu nhiên để tổng hợp cDNA. Phân tích thời gian thực được thực hiện trên Hệ thống CFX96 (Biorad, Hercules, CA, Hoa Kỳ) và biểu thức tương đối được tính bằng phương pháp ΔΔCt. Ít nhất ba thí nghiệm khác nhau đã được thực hiện.
4.7. Phân tích thống kê
Phân tích thống kê được thực hiện bằng phần mềm GraphPad Prism 8 (GraphPad Software, San Diego, CA, USA). Tất cả dữ liệu thu được từ ít nhất ba thí nghiệm độc lập được biểu thị bằng giá trị trung bình ± SEM. Chúng tôi đã đánh giá ý nghĩa thống kê với kiểm tra ANOVA hai chiều sau kiểm tra của Dunnett hoặc Sidak dưới dạng hậu kiểm. Kết quả được coi là có ý nghĩa thống kê ở p <0,05.
5. Kết Luận
Ảnh hưởng của việc sử dụng quercetin đối với pDC chưa từng được khám phá trước đây. Kết quả của chúng tôi thể hiện một bản đồ toàn diện về phản ứng viêm đối với LPS của mDC và pDC. Hơn nữa, chúng tôi mô tả tác động điều biến của việc tiếp xúc với quercetin, nhấn mạnh những điểm khác biệt và tương đồng giữa hai dòng họ DC này. Kết quả thu được từ nghiên cứu này chứng minh rằng việc sử dụng quercetin có thể tác động đến con đường gây viêm của mDC và pDC, trong cả hai trường hợp thông qua điều hòa Slpi , Hmox1 và Ap-1 .
Kết quả thu được từ WT và mô hình viêm loét đại tràng ở chuột Winnie chứng minh rằng pDCs cũng nhiều như mDC trong GALT, cho thấy rằng các nghiên cứu trong tương lai nên giải quyết ảnh hưởng của thuốc và bổ trợ cho dòng DCs quan trọng này trong các hội chứng viêm mãn tính.
Nguồn: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8348289/