Đó là thông tin được đưa ra hội thảo giới thiệu tài liệu hướng dẫn thực hành sản xuất tốt (GMP) thực phẩm chức năng (TPCN) do Cục An toàn thực phẩm (ATTP)-Bộ Y tế tổ chức ngày 29-3. Dự hội thảo còn có đại diện 52 doanh nghiệp sản xuất, kinh doanh TPCN ở miền Bắc, miền Trung.
Cục trưởng Cục ATTP Nguyễn Thanh Phong đánh giá, TPCN là một lĩnh vực hiện rất nóng và cần phải quản lý chặt hơn để những doanh nghiệp không đủ điều kiện về cơ sở sản xuất nhưng cố tình đưa ra thị trường sản phẩm không đảm bảo. Trong khi đó, TPCN là một thế mạnh của Việt Nam khi chúng ta có nền y học cổ truyền đứng thứ 2 thế giới. Dù có lợi thế về nguồn dược liệu vô cùng lớn nhưng muốn phát triển được phải áp dụng được tiến bộ khoa học kỹ thuật. Nếu sản phẩm nhiều nhưng chất lượng không tốt thì chúng ta sẽ thua ngay trên sân nhà. Vì vậy, quan điểm của Bộ Y tế là tạo điều kiện để doanh nghiệp phát triển đúng pháp luật, phát huy thế mạnh y học cổ truyền nước nhà, khuyến khích các doanh nghiệp đẩy mạnh phát triển hướng tới xuất khẩu.
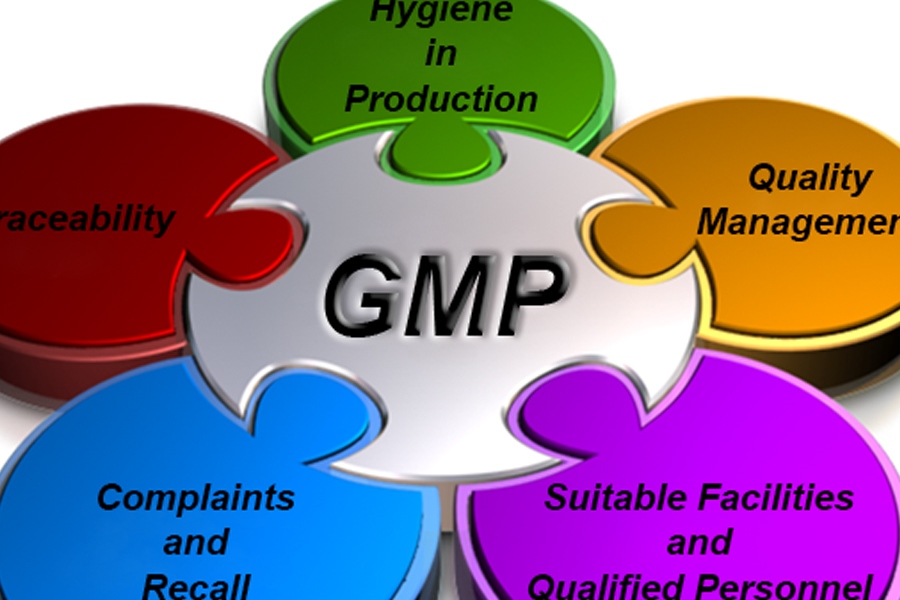
Cũng theo ông Nguyễn Thanh Phong, Bộ Y tế chủ trương phải có lộ trình áp dụng Thực hành sản xuất tốt (GMP) đối với TPCN từ giữa năm 2017. Theo dự thảo tài liệu hướng dẫn thực hành sản xuất tốt (GMP) TPCN gồm 10 nội dung chính với 5 mục: hệ thống quản lý chất lượng, nhân sự và đào tạo, nhà xưởng trang thiết bị, vệ sinh, hồ sơ tài liệu. Trong đó, về nhà xưởng và trang thiết bị, nguyên tắc để một nhà máy sản xuất TPCN đạt chuẩn GPM là phải xa nguồn ô nhiễm, côn trùng, động vật gây hại; có khu vực riêng để bảo quản, cấp phát, chế biến, đóng gói, kiểm nghiệm; có hệ thống thông gió phù hợp; được bảo trì, bảo dưỡng duy trì tốt. Đặc biệt, khu vực sản xuất phải đảm bảo sắp xếp theo nguyên tắc 1 chiều, đảm bảo các thông số phù hợp, dễ làm vệ sinh, kiểm soát nhiễm khuẩn, khu vực bảo quản phải được bố trí riêng, khu vực kiểm nghiệm phải tách biệt khỏi khu vực sản xuất… Sau khi tài liệu này được ban hành, Bộ Y tế sẽ ban hành Nghị định, thông tư để thực hiện.
GS.TS Lê Văn Truyền, nguyên Thứ trưởng Bộ Y tế – chuyên gia cao cấp về dược học cho rằng, kinh nghiệm từ triển khai và phát triển GMP từ ngành dược nước ta trước đây cho thấy, muốn đạt và phát triển nhà máy GMP thì quan trọng nhất là hệ thống quản lý, liên quan đến con người, chứ không phải chỉ là đầu tư xây dựng lại nhà xưởng to đẹp sẽ được công nhận GMP. Đến 2010, nước ta đã có 4 nhà máy dược đạt chuẩn GMPs – hệ thống GMP cao nhất được 50 nước phát triển cao nhất thế giới áp dụng. “Quá trình phát triển GMP là quá trình không bao giờ kết thúc mà sẽ phát triển không ngừng để nâng cao chất lượng sản phẩm, nâng uy tín của doanh nghiệp, bảo vệ người tiêu dùng. Đây không phải là cơ quan quản lý làm khó doanh nghiệp mà là đặt ra để bảo vệ người tiêu dùng – nhóm yếu thế và bản thân doanh nghiệp cũng phải nhận thấy, người tiêu dùng chính là nguồn sống của mình, nếu người tiêu dùng quay lưng thì doanh nghiệp cũng chết. Do vậy, khi làm tài liệu hướng dẫn này, xây dựng chính sách này, Bộ Y tế cũng phải làm rõ được việc khuyến khích doanh nghiệp phát triển GMP thì doanh nghiệp được lợi gì?”, GS.TS Lê Văn Truyền nói.
Còn theo ông Nguyễn Thanh Phong, quan điểm của Cục ATTP là việc áp dụng GMP không được quá đột ngột. Hiện có nhiều doanh nghiệp TPCN chưa đáp ứng nhanh được GMP nên Cục sẽ nghiên cứu lộ trình để không bóp nghẹt doanh nghiệp mà phải hướng đến việc tạo điều kiện cho doanh nghiệp chuyển đổi sang việc áp dụng GMP. Trên cơ sở đó, thời hạn bắt buộc áp dụng GMP TPCN có thể muộn hơn 1 chút bởi theo khuyến nghị của ASEAN thì chỉ bắt buộc từ năm 2021. Với điều kiện của Việt Nam, chúng ta có thể áp dụng sớm hơn nhưng còn phải tính toán đến điều kiện cụ thể của cộng đồng doanh nghiệp.
Người đứng đầu Cục An toàn thực phẩm cũng cho biết, sẽ nghiên cứu một cơ chế ưu đãi cho các doanh nghiệp áp dụng GMP TPCN. Hiện tại, chúng ta đã có ưu đãi là thời hạn hiệu lực công bố sản phẩm tại các nhà máy sản xuất đã đạt tiêu chuẩn GMP (hoặc tương đương hay cao hơn) là 5 năm thay vì 3 năm như các sản phẩm tại các nhà máy chưa đạt tiêu chuẩn này.